La insulina es la hormona que ayuda a que la glucosa penetre en las células para suministrarles energía. Sin la insulina, hay un exceso de glucosa que permanece en la sangre. En algunas personas, principalmente en niños, adolescentes y adultos jóvenes, el páncreas casi no produce insulina y se desarrolla la diabetes tipo 1. Para esos pacientes, científicos que trabajan en el Hospital Brigham and Women’s, el segundo hospital universitario más grande de la Escuela de Medicina de Harvard en los Estados Unidos, ha desarrollado una versión mejorada de un páncreas artificial.
El páncreas está localizado por debajo y por detrás del estómago en el ser humano. La insulina se necesita para movilizar el azúcar de la sangre (glucosa) dentro de las células. La glucosa se almacena dentro de las células y luego se utiliza para obtener energía. Con la diabetes tipo 1, las células beta producen poca o ninguna insulina.
Como síntomas del trastorno, la persona puede estar muy sedienta, sentirse hambriento con más frecuencia, sentirse cansado a toda hora, tener visión borrosa, sentir entumecimiento u hormigueo en los pies, perder peso a pesar de un aumento del apetito, y suele orinar con mayor frecuencia.
Los científicos del hospital de la Universidad de Harvard consiguieron desarrollar un dispositivo de macroencapsulación mejorado por convección que ofrece la posibilidad de que llegue a ser un tratamiento más rápido y eficaz para las personas con diabetes de tipo 1.
Más de 40 millones de personas en todo el mundo padecen diabetes tipo 1. Es una enfermedad autoinmune en la que las células beta productoras de insulina del páncreas son destruidas por el sistema inmunitario. En la actualidad, existen varios métodos de tratamiento nuevos y emergentes para la diabetes de tipo 1, como los dispositivos de macroencapsulación, que consisten en compartimentos diseñados para albergar y proteger las células secretoras de insulina.
Como si fuera una armadura de los caballeros medievales, diferentes grupos científicos han trabajado en diversos modelos de páncreas bioartificial para proteger a las células contra los ataques del sistema inmune del mismo huésped. También han buscado que el dispositivo permita la entrada y salida de nutrientes para que las células puedan seguir sobreviviendo.
Pero este tipo de desarrolllos ha tenido varias limitaciones y la transferencia para su uso en seres humanos ha sido un reto. El equipo de investigadores del Hospital Brigham and Women’s, en colaboración con colegas de otras áreas de la Universidad de Harvard y la Facultad de Medicina de la Universidad de Massachusetts, diseñaron un macroencapsulación mejorado por convección, que puede bañar continuamente las células con los nutrientes que necesitan y mejorar la capacidad de carga celular, al tiempo que aumenta la supervivencia celular, la sensibilidad a la glucosa y la secreción oportuna de insulina.
En modelos preclínicos en animales, el dispositivo respondió rápidamente a los niveles de azúcar en sangre a los dos días de ser implantado. Los resultados se publican en The Proceedings of the National Academy of Sciences. “Gracias a los recientes avances, estamos cada vez más cerca de disponer de una fuente ilimitada de células tipo beta que puedan responder a la glucosa segregando insulina, pero el siguiente reto es introducir esas células en el cuerpo de forma mínimamente invasiva y que tengan una longevidad con una función máxima”, dijo el científico, Jeff Karp, doctor, investigador principal y catedrático distinguido de Anestesiología Clínica, Medicina Perioperatoria y del Dolor.
“Nuestro dispositivo demostró una mayor viabilidad celular y un retraso mínimo tras el trasplante. Es una sólida prueba de concepto preclínica para este sistema”, agregó. Los dispositivos similares actuales son dependientes de la difusión: los nutrientes se difunden a través de la membrana exterior y sólo un número de células puede recibir nutrientes y oxígeno y, a su vez, secretar insulina.
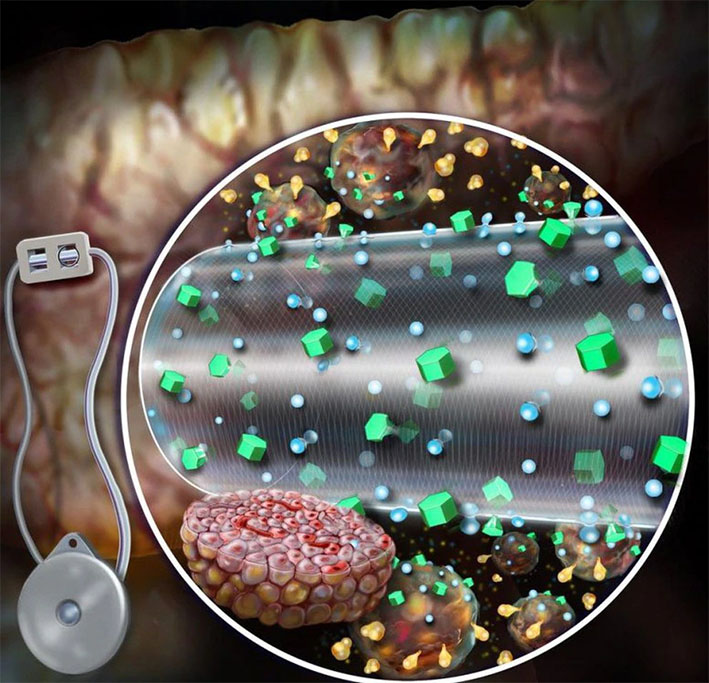
El que se diseñó ahora en los Estados Unidos busca proporcionar nutrientes por convección a través de un flujo continuo de fluido a las células encapsuladas. Esto permite que múltiples capas de células crezcan y sobrevivan. El prototipo del equipo cuenta con dos cámaras: una cámara de equilibrio que recoge los nutrientes del entorno y una cámara celular que alberga las células protegidas. La primera cámara está encerrada en politetrafluoroetileno, una membrana semipermeable con poros que permiten la entrada de fluidos. Una membrana interior adicional que rodea a la segunda cámara permite el transporte selectivo de nutrientes y protege contra las respuestas inmunitarias.
Los líquidos perfundidos fluyen a través de una fibra hueca porosa que llega a la cámara celular con una concentración de nutrientes similar a la del tejido que rodea el implante. La fibra permite que la insulina y la glucosa pasen libremente, pero no permite la entrada de moléculas del sistema inmune que podrían atacar a las células encapsuladas.
“La aplicación de islotes derivados de células madre para el tratamiento de la diabetes autoinmune o de tipo 1 se ha trasladado ahora al punto de encontrar un método para proteger las células del rechazo inmunológico y maximizar su supervivencia y función tras el trasplante”, dijo el coautor Doug Melton, quien es parte del Departamento de Células Madre y Biología Regenerativa del Instituto de Células Madre de Harvard. “La macroencapsulación mejorada por convección puede ser un enfoque viable para lograr todos estos objetivos”.
El dispositivo ofrece muchas ventajas respecto a las bombas de insulina convencionales y permite a las células secretar insulina a demanda y dejar de hacerlo rápidamente cuando los niveles de glucosa en sangre disminuyen. En modelos de roedores con diabetes de tipo 1, el dispositivo mejoró la supervivencia y la secreción de insulina de las células y empezó a disminuir el nivel de glucosa en sangre ya dos días después del trasplante.
“El dispositivo tiene el potencial de ser un sistema autónomo que no requeriría la recarga y sustitución constantes de los cartuchos de insulina”, dijo el autor principal, el doctor Kisuk Yang, ex becario postdoctoral en el Laboratorio Karp y ahora profesor de la División de Bioingeniería de la Universidad Nacional de Incheon en Corea del Sur.
Por su capacidad de respuesta, este dispositivo y el novedoso método de flujo mejorado podrían ser especialmente útiles para las personas con diabetes lábil, es decir, las personas cuya diabetes da lugar a oscilaciones imprevisibles de los niveles de azúcar en sangre, comentó el doctor Eoin O’Cearbhaill (ahora en el Colegio Universitario de Dublín, Irlanda), otro de los investigadores que ayudó en el desarrollo del dispositivo mientras trabajaba como becario posdoctoral en el laboratorio de Karp. El equipo señala las direcciones futuras que habrá que seguir para llevar el dispositivo a la clínica, incluyendo el aumento de la capacidad de carga de células y la optimización del sistema de flujo perfundido para el uso humano.
“En general, estos resultados ponen de relieve las ventajas significativas sobre los dispositivos existentes basados en la difusión, incluyendo la mejora de la supervivencia de las células, la reducción de la encapsulación fibrosa que puede comprometer la funcionalidad con el tiempo, y las tasas más rápidas de encendido y apagado de la secreción de insulina”, dijo Karp. “Este enfoque tiene el potencial de mejorar el éxito de las terapias de reemplazo de células beta para ayudar a muchos pacientes con diabetes tipo 1 y sus familias a manejar esta desafiante enfermedad”, sostuvo.
El trabajo fue apoyado por la Fundación de Investigación de la Diabetes Juvenil, y los Institutos Nacionales de Salud, y una beca de investigación de la Universidad Nacional de Incheon, en Corea del Sur, en 2021.
Infobae


